内蒙古自治区东北部、 辽宁与吉林省西部、 黑龙江省大部等严寒村镇近65%的生活用水取自地下,2014年针对黑龙江省18个村镇分散地下水质进行监测,发现受原生地质环境与地层锰矿影响,冬季村镇地下水Fe2+、 Mn2+浓度范围分别为0.44~20.4 mg·L-1、 0.65~2.55 mg·L-1,属于典型的高铁锰地下水,按《地下水环境质量标准(GB 3838-2002)》中Ⅲ类水标准进行评价,Fe2+、 Mn2+浓度超标严重,最大超标倍数分别达67、 24.5倍,严重威胁村镇经济发展与人民群众身体健康,研发严寒村镇高铁锰饮用水净化技术具有重要现实意义.
生物法作为地下水除铁锰的热点研究方法,虽在工艺及微生物方面均取得了一定的成绩,但以下问题亟待解决: ①严寒村镇地下水处于低温环境,低温条件下微生物面临活性低、 滤层培养成熟缓慢、 处理效果不佳等难题,因此如何克服低温影响,实现铁、 锰低温环境下的有效去除已成为饮用水处理领域共同关注的瓶颈问题.②目前除铁锰菌大都局限于细菌形态观察、 分离、 纯化与鉴定.探究高效除铁锰菌的接种方式及其应用效能,将为生物除铁锰滤池的构建与快速启动提供有力的技术支持.③生物滤池除铁锰涉及滤料吸附作用、 生物菌氧化作用及铁锰氧化物的自催化作用,但各自作用的贡献率还有待进一步明确.
本研究将以碳化稻壳颗粒为基质,筛选优势铁锰氧化菌,耦合净化严寒村镇地下水中铁锰; 并优选载银活性炭颗粒去除生物碳化稻壳滤柱处理后的残余菌,保证饮用水安全; 探究装置低温快速启动方式,探讨生物滤层内铁锰氧化去除机制; 该研究将为严寒村镇高铁锰地下饮用水处理技术开发提供理论依据,具有重要学术价值.
1 材料与方法 1.1 试验装置与试验用水
试验装置见图 1,包括曝气池、 菌液池、 两个滤柱、 中间水池与出水池.滤柱Ⅰ、 Ⅱ直径80 mm,自上至下依次添装1 300~1 500 mm高滤料与80~100 mm高鹅卵石与锰砂混合承托料,滤柱Ⅰ、 Ⅱ滤料分别为碳化稻壳颗粒(CRH600,20~120目,自制[4])与载银活性炭颗粒(5~10 目,购自东莞市樟木头枫林活性炭有限公司),滤柱Ⅱ用于去除滤柱Ⅰ出水的残余铁锰与生物菌.试验水温通过制冷机控制在17℃(此温度设定主要考虑铁锰氧化菌的活性).
图 1 试验装置示意
试验用水为静置24 h以上的自来水配制的FeSO4与MnSO4混合溶液,控制Fe2+、 Mn2+质量浓度分别为3.95~18.54 mg·L-1、 0.57~2.28mg·L-1,pH值为6.8~7.2; 滤柱Ⅰ采用跌水曝气,控制[O2]为4~5 mg·L-1.
1.2 优势菌种与菌悬液
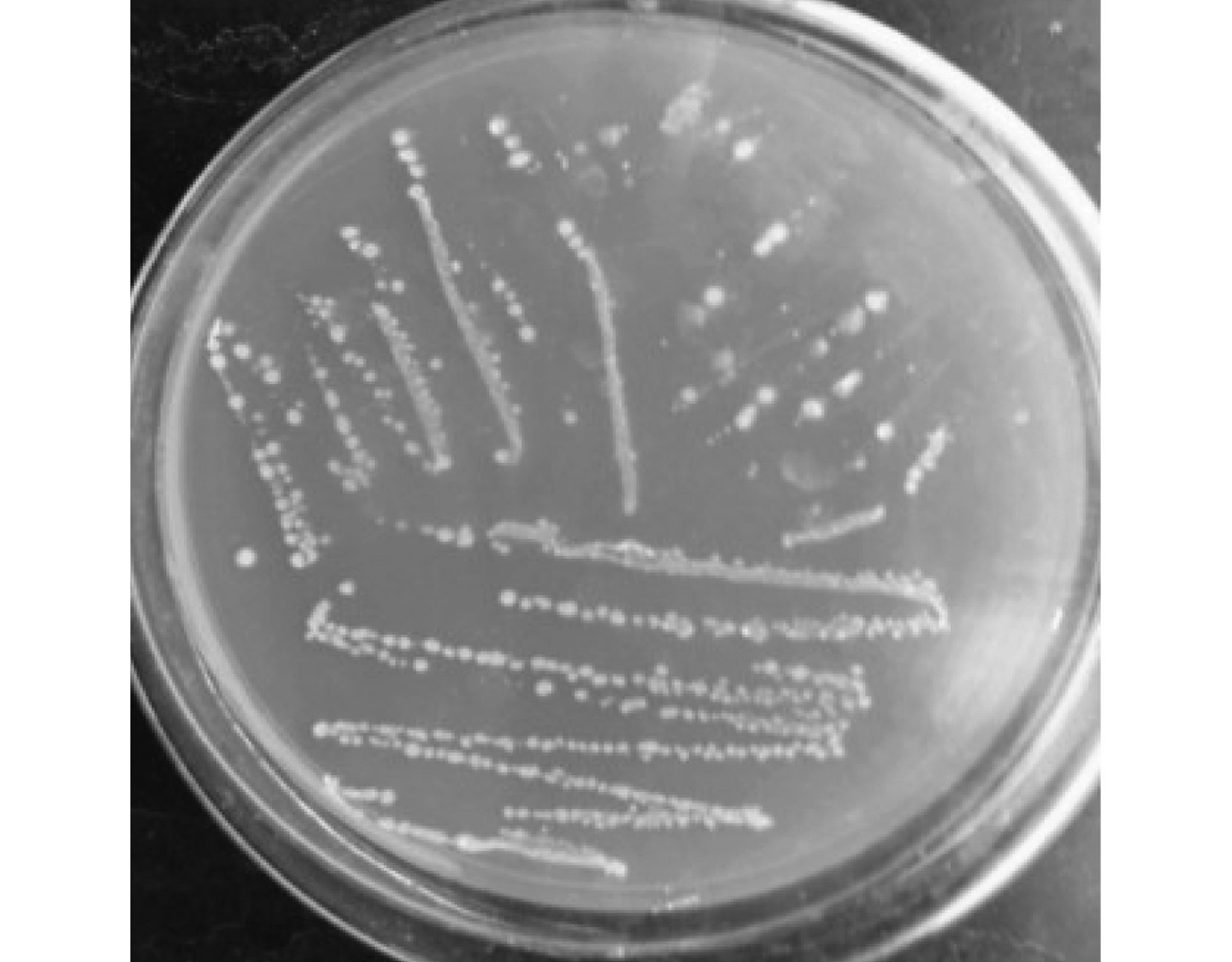
从黑龙江省哈尔滨市红旗农场地下水井周围采集泥样,经菌株分离初筛复筛与16S rDNA测序分析,确定对铁锰降解率最高的优势菌株归属于巨大芽孢杆菌 (Bacillus megaterium,GenBank登录号为KP241857).该菌株在培养基中的菌落形态如图 2所示.
图 2 巨大芽孢杆菌的菌落形态
将Bacillus megaterium菌株接种于锥形瓶(盛有5mL PYCM改良培养基)中,17℃摇床活化12 h,转速125 r·min-1,取活化后的菌液2 mL于200 mL PYCM改良培养基中,以同样条件培养24h至对数生长末期,培养液离心(4 500 r·min-1,10 min)收集菌体,无菌生理盐水洗涤3次,重悬于HEPES缓冲液(pH 7.0),制备菌悬液,确定菌浓度(平板稀释计数法),进而配制试验所需的4.0×109CFU·mL-1菌悬液.其中,PYCM改良培养基成分如下: 蛋白胨0.5 g,葡萄糖0.3 g,酵母浸膏0.2 g,MnSO4·H2O 0.2 g,K2HPO4 0.1 g,MgSO4·7H2O 0.2 g,NaNO3 0.2 g,CaCl2 0.1 g,(NH4)2CO3 0.1 g,柠檬酸铁铵0.8 g,定容至1 000 mL,pH值6.8~7.2.
1.3 分析项目与测定方法
根据文献,进出水Fe2+、 Mn2+、 菌浓度的测定分别采用邻菲罗啉分光光度法、 高碘酸钾氧化分光光度法、 平板法,Fe2+、 Mn2+质量浓度标准曲线方程分别为y=0.182 8x-0.007 5(R2=0.999 6)、 y=0.038 3x+0.004 4 (R2=0.999 1).
1.3.1 装置启动与稳定运行研究分析
装置启动初期,为评价生物菌除铁锰作用,将高浓度4.0×109 CFU·mL-1铁锰氧化菌液注入铁锰吸附饱和的碳化稻壳滤柱Ⅰ中,浸泡1 d,控制滤速2 m·h-1,循环运行4 d,在7、 13、 19 d分别将滤速提高至3、 4、 5 m·h-1,反冲洗强度相应提高至4、 6、 8 L·(s·m2)-1,反冲洗周期2 d(3 min),在无培养基、 低营养源的条件下,利用地下水自身营养,低滤速驯化培养富集功能菌群,根据出水铁锰浓度,分析滤柱Ⅰ的快速启动.第25 d,进出水暂停,滤柱Ⅰ被进水浸泡6 d,待第32 d以2 m·h-1滤速低速启动,考察滤柱抗冲击能力与稳定性.滤柱Ⅱ控制滤速5 m·h-1,反冲洗强度8 L·(s·m2)-1,反冲洗周期2 d(3 min),考察滤柱Ⅱ进出水铁锰质量浓度与细菌浓度.稳定运行阶段后期,若滤层表面出现铁泥板结、 轻微裂缝现象,反冲洗周期、 强度、 时间分别取24 h、 10 L·(s·m2)-1、 5 min.
1.3.2 Fe2+去除机制分析
待滤柱Ⅰ启动成功后,基于接触氧化法与生物法,对比分析不同滤速条件下滤柱Ⅰ每d各滤层沿程(自上而下20、 40、 60、 80、 100、 120、 140 cm)出水的总铁、 Fe2+浓度及反应速率,考察除铁机制.设定反冲洗强度、 时间、 周期分别为10 L·(s·m2)-1、 2 min、 2 d,进水总铁浓度分别为2、 5、 10 mg·L-1,滤速分别为3m·h-1、 5m·h-1,滤速固定时,滤柱Ⅰ在每个进水总铁浓度下运行7 d.
1.3.3 Mn2+去除机制分析
采用SEM表征滤柱成功启动后30 cm深度处滤料表面与反冲洗泥样的微生物及铁锰氧化物附着情况.采用FTIR对原始碳化稻壳与成熟滤料进行分析,进一步确定滤料表面附着的片层状或颗粒结构物质.采用XPS对反冲洗泥样进行分析,明确滤料表面元素价态.采用Raman光谱分析不同运行时间条件下滤柱中30cm深度处的滤料,明确MnOx的物相组成.自滤柱成功启动(15d)后对不同运行时间的滤料表面与反冲洗中的水钠锰矿进行EPR分析,明确Mn2+去除机制.
2 结果与讨论 2.1 培养与稳定阶段的运行情况
向滤柱Ⅰ投加大量菌种后,循环往复供给优势菌液,利于铁锰优势菌株接种于滤料表面且生长繁殖,接种后需对细菌进行低温、 贫营养等自然选择驯化,滤柱Ⅰ以2 m·h-1的滤速启动运行,即是为了减小水流冲刷对驯化初期滤层间隙及滤料表面微生物菌群的影响,本试验微生物驯化培养与装置运行同步进行,因未研究驯化阶段滤料上微生物数量随时间增长变化关系,无法明确判断滤料是否成熟,但可发现当进水水力负荷达到设计值(滤速控制在5 m·h-1)时,一定数量的优势铁锰氧化菌可见,且滤层除铁锰能力增强,此时可认定驯化培养工作完成.
2.1.1 培养期滤柱Ⅰ、Ⅱ出水Fe2+、Mn2+去除效果
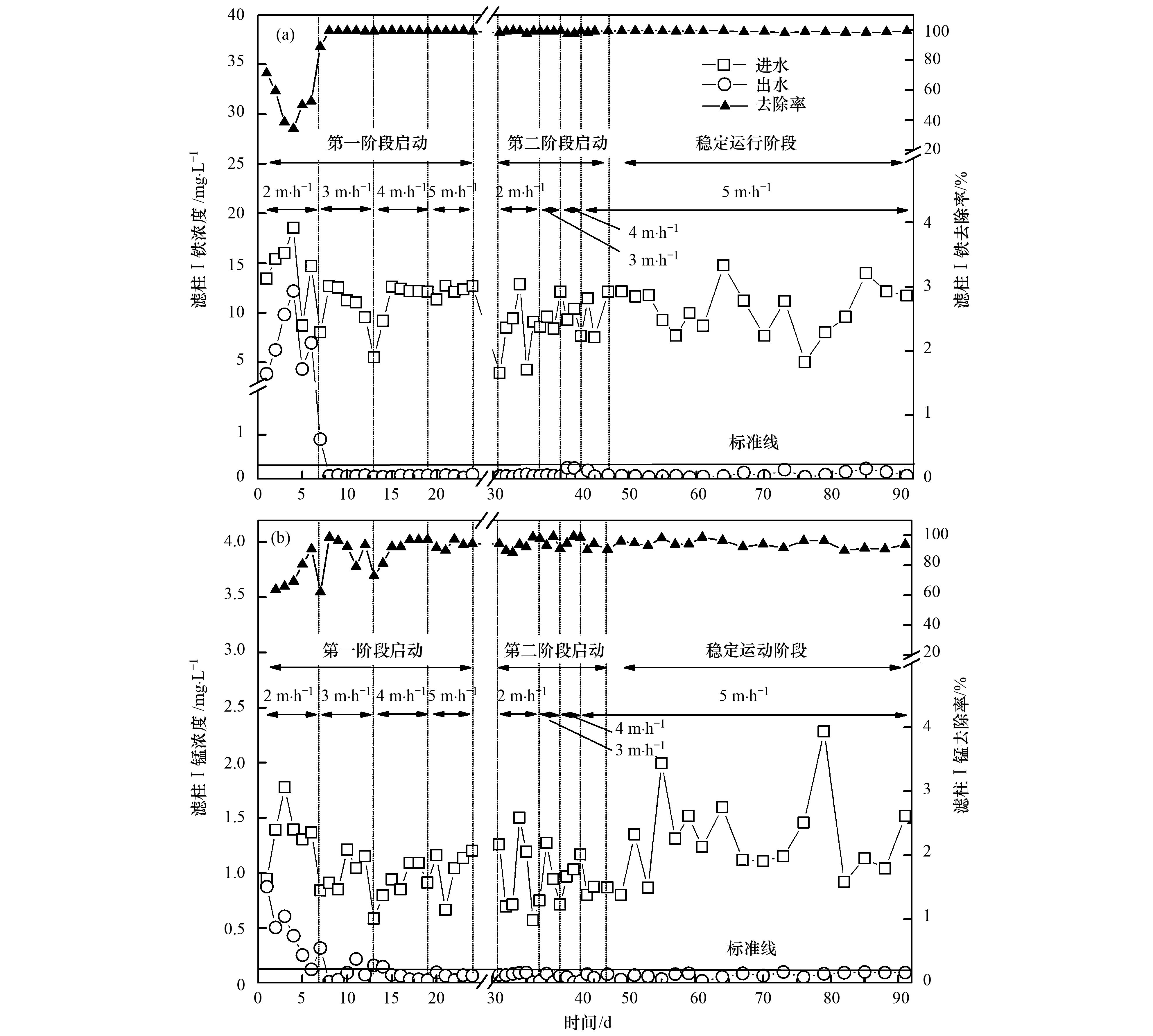
滤柱Ⅰ除铁效果如图 3(a)所示,前4 d出水Fe2+波动幅度大、 去除率低且出水不达标,这是由于接种菌株在滤料表面附着松散且处于环境适应阶段,铁菌催化氧化Fe2+能力有限; 第5~8 d,Fe2+去除率持续上升,即便第7 d滤速由2 m·h-1增至3 m·h-1,出水Fe2+波动幅度仍逐渐减小,这可能由于Fe2+除生物氧化去除外,DO充足(4~5 mg·L-1)时还依靠化学氧化所致.滤柱Ⅰ除锰效果如图 3(b)所示,前6 d滤柱Ⅰ对Mn2+的去除率逐渐升高,由7%增至91%,但出水Mn2+浓度均高于0.1 mg·L-1; 第7d、 13 d滤速改变时,Mn2+去除率均骤降,7~14 d出水Mn2+浓度波动幅度较大,第15 d后出水Mn2+浓度均低于0.1mg·L-1,去除率均在90%以上,该效果较Fe2+出现的晚8 d,这与Fu等和Phatai等[10]的结论一致,这是由于Fe2+作为菌的基础代谢底物,为菌的生长繁殖提供了大部分的能量,而Mn2+的去除需菌具备较高活性且达到一定数量后才得以体现.综合出水Fe2+、 Mn2+去除效果,滤柱Ⅰ运行15 d滤膜趋于成熟.滤柱Ⅱ除Fe2+、 Mn2+效果如图 4所示,出水Fe2+、 Mn2+浓度均远低于0.1mg·L-1.
图 3 滤柱Ⅰ 出水Fe2+、 Mn2+去除效果
图 4 滤柱Ⅱ 出水Fe2+、 Mn2+去除效果
滤柱Ⅰ两次启动运行15 d后,不断提高滤速至5m·h-1,且停滞6 d再次低滤速启动,出水Fe2+、 Mn2+浓度不受滤速改变、 停滞工况的影响,满足《生活饮用水卫生标准》(GB 5749-2006),且去除率均在90%以上,表明该试验在低滤速条件下建立了稳定的铁锰优势菌种的微生态系统,系统抗负荷、 抗冲击能力较强.
2.1.2 培养期滤柱Ⅱ出水细菌的去除情况
滤柱Ⅱ除铁锰氧化菌效果如图 5所示.
图 5 滤柱Ⅱ 出水铁锰氧化菌去除效果
由图 5可知,培养初期滤柱Ⅰ内滤膜不成熟,滤料表面菌附着力差,致使滤柱Ⅱ进水细菌量高达482 CFU·mL-1; 随着滤柱Ⅰ滤膜趋于成熟,进入滤柱Ⅱ的细菌量逐渐降低,但水力条件的提升使滤柱Ⅱ进水细菌量突增; 滤速由2 m·h-1增至3 m·h-1后,进水细菌量增加93 CFU·mL-1(338~441 CFU·mL-1); 滤速增至4 m·h-1后,进水细菌量增加64 CFU·mL-1(232~296 CFU·mL-1); 滤速增至5 m·h-1后,进水细菌量仅增加21 CFU·mL-1,表明滤柱Ⅰ内滤膜抗冲击力强,已趋于成熟.培养期滤柱Ⅱ出水细菌量始终低于100 CFU·mL-1,均达饮用水标准,这可能由于载银活性炭颗粒吸附菌、 抑菌或杀菌作用所致; 此外,水中银离子浓度一直未超标,表明选用的载银活性炭颗粒抗银流失性能强、 安全可靠.
2.1.3 稳定阶段滤柱Ⅰ、 Ⅱ出水Fe2+、 Mn2+与细菌的去除情况
进入稳定阶段,铁、 锰、 细菌浓度均达到国家标准,始终低于0.3 mg·L-1、 0.1 mg·L-1与100 CFU·mL-1.
2.2 生物滤层内铁氧化去除机制
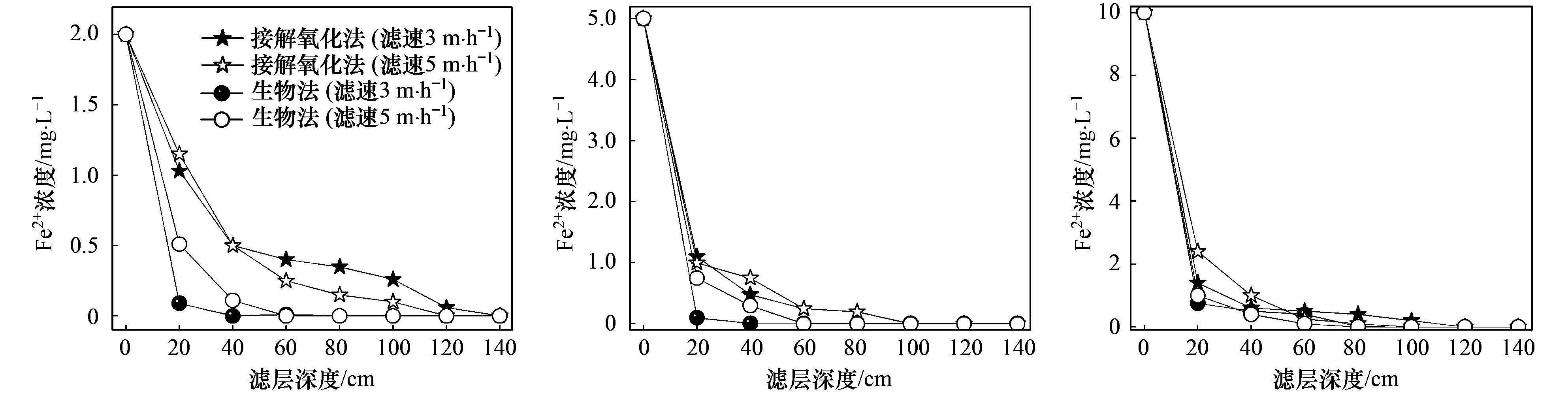
基于接触氧化法与生物法,对比分析不同滤速时滤柱Ⅰ沿程出水的总铁、 Fe2+浓度及反应速率,研究生物滤层除铁机制,结果见图 6、7.
图 6 不同滤速、 进水总铁浓度条件下滤柱Ⅰ 中总铁去除效果
图 7 不同滤速、 进水总铁浓度条件下滤柱Ⅰ 中Fe2+去除效果
2.2.1 进水总铁浓度对去除效果影响分析
针对滤柱Ⅰ相同滤速、 不同进水总铁浓度的试验结果,由图 6可知,滤层深度120 cm范围内,生物法出水总铁浓度一般低于接触氧化法,表明除铁过程存在生物作用; 偶尔接触氧化法除铁效果更佳但差别不明显,这可能受反冲洗等因素影响或某处滤层铁氧化菌少所致.由图 7可知,生物法与接触氧化法对应的出水除Fe2+效果差别不大,但生物法的除铁速率均高于接触氧化法,20 cm处的滤层对Fe2+的生物氧化率超过75%,而对Fe2+的接触氧化率仅为20%~50%,这可能由于滤柱上部富氧,铁氧化菌在有氧条件下可利用Fe2+作为电子供体为自身提供能量,强力促进Fe2+氧化.
2.2.2 不同滤速对滤柱Ⅰ中铁去除效果影响分析
针对滤柱Ⅰ不同滤速、 进水总铁浓度的试验结果,生物法除总铁、 Fe2+能力均高于接触氧化法,受滤速的影响较大,且进水总铁浓度越低,滤速影响越显著.由图 6可知,接触氧化法对于总铁的去除效果相差不大,而在生物法中,滤层上部20 cm范围内低滤速对应的滤柱沿程出水总铁浓度略低,滤层中部(40~100 cm)高滤速对应的滤柱沿程出水总铁浓度略低,除总铁能力差别明显.由图 7可知,滤层上部40 cm范围内,不同滤速时接触氧化法除Fe2+效果差别不大,生物法除Fe2+效果随着滤速增加略有下降; 对于相同滤层深度,高滤速出水Fe2+浓度较低滤速的高,表明提高滤速后生物法需更大的滤层深度氧化Fe2+.当进水总铁浓度大于5 mg·L-1时,滤层深度大于60 cm后,两种方法出水Fe2+浓度几乎不受滤速影响且均至去除极限,表明Fe2+去除主要集中于滤层上部60 cm范围内.
综上,除铁机制主要是物化作用,辅以生物作用,铁氧化菌促进了Fe2+的氧化速率,增强了微生物对滤层截留铁氧化物的能力; 滤速是影响生物除Fe2+能力的关键因素,该结论与文献研究结果一致.
2.3 生物滤层内锰氧化去除机制 2.3.1 滤柱启动后培养初期成熟滤料表征
(1) 微生物形态分析
装置运行第16 d时,滤柱Ⅰ、 滤柱Ⅱ成熟滤料表面与反冲洗水中泥样的微生物形态如图 8所示.
图 8 滤柱Ⅰ、 滤柱Ⅱ 滤料与反冲洗泥样的微生物SEM图
图 8(a)与图 8(b)中均存在大量的细菌与片层状或颗粒结构,其在反冲洗水中的量较大,该微生物可能主要为接入的原始Bacillus megaterium菌群,其依靠进水中铁、 锰等地下水自身营养,经适应期对数生长期培养后占据生态位的主体,后续应采取分子生物学手段进一步确认细菌的种类; 片层状或颗粒结构可能为Bacillus megaterium菌的代谢产物及截留吸附物.由图 8(c) 与图 8(d)可知,滤柱Ⅱ成熟滤料表面与反冲洗水Bacillus megaterium菌的数量较少,这表明滤柱Ⅰ滤料表面形成的生物除铁锰活性滤膜成熟且稳定.
(2) 滤料表面物质分析
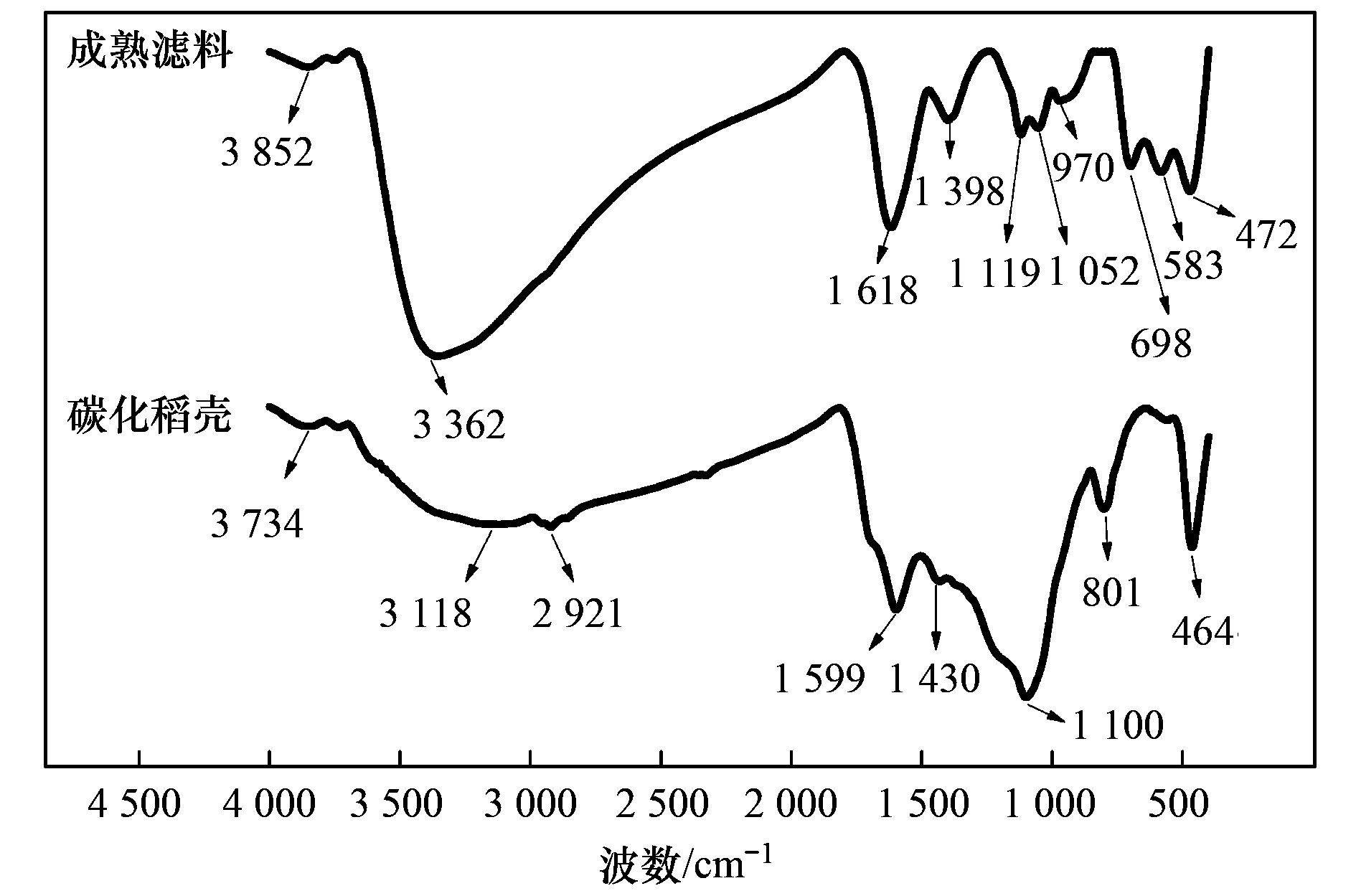
为进一步确定滤料表面附着的片层状或颗粒结构物质,采用FTIR对成熟滤料进行分析.原始碳化稻壳与滤层成熟滤料的FTIR如图 9所示.从中可知,3 362 cm-1处吸收峰表明了OH-存在,1 618 cm-1与1 398 cm-1处吸收峰表明了有机物的存在,因进水(配水)中几乎不存在有机物,故此处的有机物即代表微生物; 698 cm-1处吸收峰表明了Si—C的存在,这是由于碳化稻壳本身成分所致; 970 cm-1处出现了α-FeOOH 的特征吸收峰; 583 cm-1处出现了 Mn—O的特征吸收峰. 由此可见,成熟滤料存在大量的微生物与铁、 锰氧化物.
图 9 碳化稻壳与成熟滤料的FTIR图谱
(3) 滤料表面元素价态分析
为进一步研究生物除铁除锰过程中铁、 锰的去除机制以及非液相产物上铁、 锰的价态组成,本试验采用XPS对反冲洗泥样进行分析,结果见图 10.
图 10 反冲洗泥样的XPS分析图谱
图 10分别为C1s、 O1s、 Mn2p、 Fe2p的XPS光谱图,通过找到峰值处所对应的横坐标结合能(binding energy)来判定是否存在某种元素及该元素的存在形式.从图 10(a)可知,C1s的出峰位置在284.6 eV及288.5 eV处,分别表明样品中存在C—C、 C—H键与酯类官能团,因酯类化合物为微生物生长所需且为微生物氧化产物的重要组成部分,故表明样品中存在微生物.从图 10(b)可知,O1s的出峰位置在529.7 eV及530.7 eV处,分别表明样品中存在晶格氧O2-、 醇羟基OH-,O2-的出现通常为氧与金属元素的结合,进而证明了铁锰氧化物的存在,后者则表明样品表面存在OH-吸附情况.从图 10(c)可知,Mn2p3/2峰值出现在641.9 eV.锰在反应器中一般以多种价态形式存在,通常用MnOx来表示锰的化学结构: 当x为1、 2时,锰的化合价分别为+2、+4,对应峰值在640.6eV、 642.2eV处; 锰还可以+3价存在,如MnOOH,出峰位置为641.5eV.因本研究的Mn2p3/2结合能为641.9eV在641.5 eV与642.2 eV之间,故认为MnOx中Mn的平均价态在+3与+4之间.从图 10(d)可知,Fe2p3/2的出峰位置在711.6 eV处,该处是铁羟基氧化物的特征峰,该氧化物一般存在于针铁矿或水铁矿中; Søgaard等研究表明针铁矿或水铁矿峰值分别为711.9 eV与711.6 eV,可确定样品表面存在的羟基氧化物是无定型的水铁矿,这与Katsoyiannis等的生物除铁研究结果一致.
(4) MnOx物相分析
经历不同运行时间的滤料的Raman光谱分析见图 11.从中可知,滤料成熟初期,Raman光谱主要有 3个峰,Raman 位移分别为503、 576和669 cm-1,表明锰氧化物为水钠锰矿(birnessite)型,运行时间越长,水钠锰矿峰值强度减弱,此时水钠锰矿的结晶度很低或呈无定形相.
图 11 不同运行时间的滤料表面锰氧化物的Raman光谱
2.3.2 滤柱除锰机制分析
Kim 等[23]采用EPR光谱区分17℃ 温度下水钠锰矿生物或无机(非生物)作用形成机制: 当光谱波长ΔH为(600~1 200)×10-4 T(高斯)时,除锰机制主要是生物作用,ΔH大于1 200×10-4 T时,主要依靠非生物作用除锰.
自滤柱成功启动(15 d)后对不同运行时间的滤料表面与反冲洗水泥样中的水钠锰矿进行EPR光谱分析,结果见图 12.
图 12 不同运行时间时滤料表面与反冲洗泥样中水钠锰矿EPR光谱波长ΔH
由图 12可知,随着运行时间的延长,滤料表面水钠锰矿的ΔH值也随之增加,250 d内,ΔH值增加快速,当400 d后,ΔH从(600~1 200)×10-4 T范围变化升至1 200×10-4 T以上,表明400 d后除锰机制从生物作用转变为物化作用,物化作用主要为反应速度极快的自催化氧化.反冲洗水中水钠锰矿的ΔH值围绕600×10-4 T上下波动,表明生物除锰存在于整个过滤过程,此处的水钠锰矿主要是生物作用形成,来自滤料生物膜表面,易被水冲刷.试验过程中滤柱膨胀幅度低,表明物化形成的水钠锰矿紧固滤料表面,极少被冲刷.
检验生物作用与物理化学作用形成水钠锰矿的结构差异,不同运行时间滤料表面水钠锰矿的SEM分析见图 13.
图 13 不同运行时间滤料表面水钠锰矿的SEM 图
由图 13可知,生物作用形成的水钠锰矿呈蓬松的板结构; 物理化学作用形成的水钠锰矿呈珊瑚或海绵状结构,Post指出水钠锰矿由八面体MnO6层堆叠而成,层间充满阳离子和水,该结构特征易参与氧化、 阳离子交换反应,这表明水钠锰矿自催化氧化能力强.SEM也证实,水钠锰矿是结晶或无定形的.
综上所述,在滤料成熟阶段与稳定运行初期主要依靠的是生物作用,稳定运行后期物理化学作用占优势.具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
3 结论
(1) 生物滤柱Ⅰ耦合碳化稻壳与优势铁锰氧化菌,采用全循环、 低滤速方式实现15 d快速启动滤柱,运行中逐渐提升滤速与反冲洗强度顺应实际需求,滤柱Ⅱ以载银活性炭颗粒去除滤柱Ⅰ出水残余菌,滤柱Ⅰ稳定阶段铁、 锰的平均去除率为98.99%、 93.92%,平均出水浓度为0.105 mg·L-1、 0.727 mg·L-1; 滤柱Ⅱ稳定阶段铁、 锰、 细菌的平均去除率为91.87%、 82.76%、 91.14%,平均出水浓度为0.009 mg·L-1、 0.012 mg·L-1、 13 CFU·mL-1; 两滤柱出水均达到国家生活饮用水卫生标准(GB 5749-2006).
(2) 除铁机制主要为物化作用,辅以生物作用,铁氧化菌促进了Fe2+的氧化速率,增强了微生物对滤层截留铁氧化物的能力; 滤速是影响生物除Fe2+能力的关键因素.
(3) SEM、 FTIR与XPS分析表明成熟滤料存在大量的微生物与铁、 锰氧化物; MnOx中Mn的平均价态在+3与+4之间; Raman光谱分析进一步明确了MnOx为水钠锰矿(birnessite).EPR光谱与SEM分析推断在滤料成熟阶段与稳定运行初期除锰主要依靠生物作用、 稳定运行后期物理化学作用占优势.